超氧化物歧化酶(SOD)凭借独特的金属催化位点,是机体抵御活性氧(ROS)的第一道防线,已被广泛用于氧化应激相关疾病的治疗。
然而,天然SOD的活性受限于氨基酸残基对金属离子的刚性配位。
2025年11月18日,吉林大学张皓、刘树威在国际知名期刊Nature Communications发表题为《Cu/Zn/histidine supramolecular assemblies with optimized Cu catalytic sites as an alternative of superoxide dismutase》的研究论文,Hao Jin论文第一作者,张皓、刘树威为论文共同通讯作者。

受CuZn-SOD中Cu2+/组氨酸残基配位启发,作者计算了组氨酸不同基团与Cu2+形成四配位结构时配位键断裂/重组的吉布斯自由能变化,发现“一氨基、一羧基、二咪唑”配位模式的总能量及单键断裂能最低,可兼顾位点稳定性与催化活性。
所制备的Cu/Zn/组氨酸(CuZnHis)超分子组装体表现出高达37900 U/mg的SOD活性,为天然Cu-Zn-SOD的5.4倍以上。作为氧化应激相关疾病治疗的范例CuZnHis组装体促进巨噬细胞从M1向M2极化,上调抗炎因子表达,并在雄性动物模型中显著抑制牙周炎。
细胞内氧化还原稳态是生命活动的基础,其失衡—尤其是活性氧(ROS)水平升高—可引发200余种氧化应激相关疾病,如类风湿性关节炎、动脉粥样硬化、牙周炎等。SOD作为清除超氧阴离子(O2·-)的第一道防线,通过金属离子与氨基酸残基形成的独特催化位点实现抗氧化功能。其中,Cu-Zn-SOD的Cu2+与四个组氨酸咪唑基配位,Zn2+维持结构完整;Mn-SOD的Mn2+则与三个咪唑基及一个天冬氨酸羧基配位。然而,天然SOD活性仅2500–7000 U/mg,远不能满足临床需求。
以Cu-Zn-SOD为例,其催化循环需断裂/重建Cu2+-咪唑配位键以实现Cu2+/Cu+氧化还原。但四咪唑配位空间位阻大,既不利于底物接触,又使整体能量较高;且Cu2+/咪唑键断裂能并非最低,限制了催化效率。受Mn-SOD羧基配位启发,本文在组氨酸层面引入额外氨基与羧基配位,通过熵驱动自组装构建Cu/Zn/组氨酸超分子组装体,实现催化位点精准优化。该策略显著降低Cu2+-配体键断裂能,赋予组装体37900 U/mg的超高SOD活性,并在牙周炎模型中展现优异抗氧化与抗炎疗效,为高效人造SOD的设计提供了新范式。
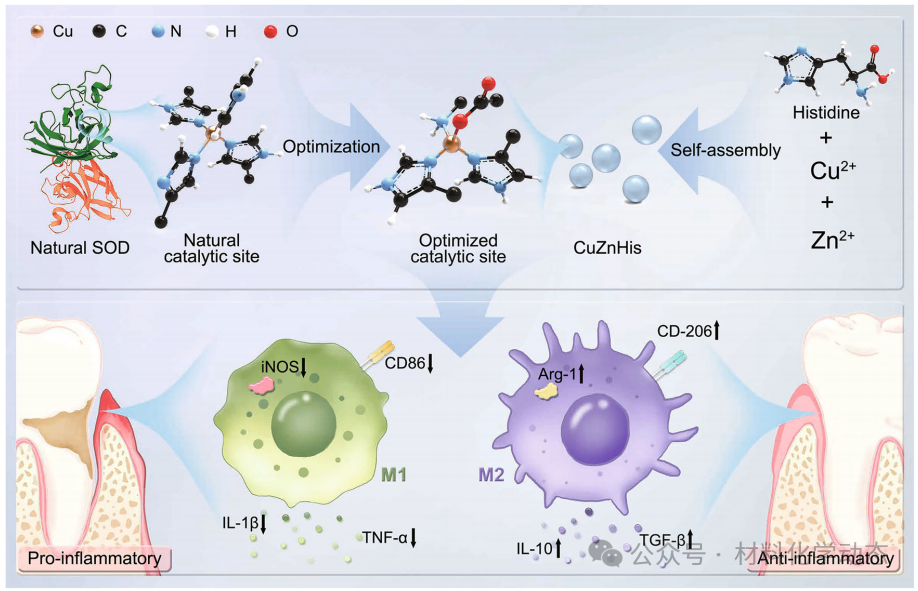
图1:工作总示意—优化Cu位点(1氨基-1羧基-2咪唑)并自组装成CuZnHis纳米酶,可清除ROS、促M2极化、治疗牙周炎。
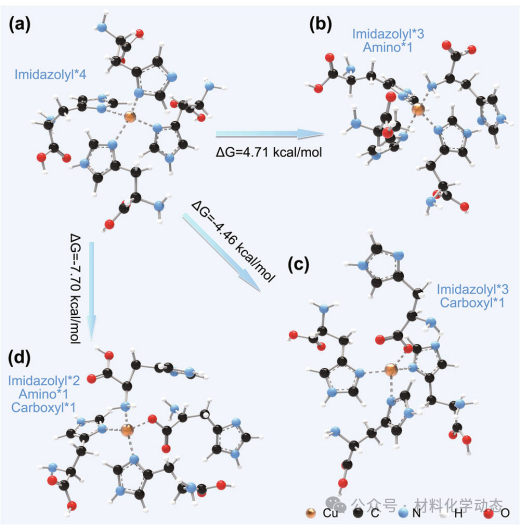
图2:四种Cu配位结构热力学稳定性比较,1氨基-1羧基-2咪唑(结构D)能量最低、位阻最小,为最优催化构型。
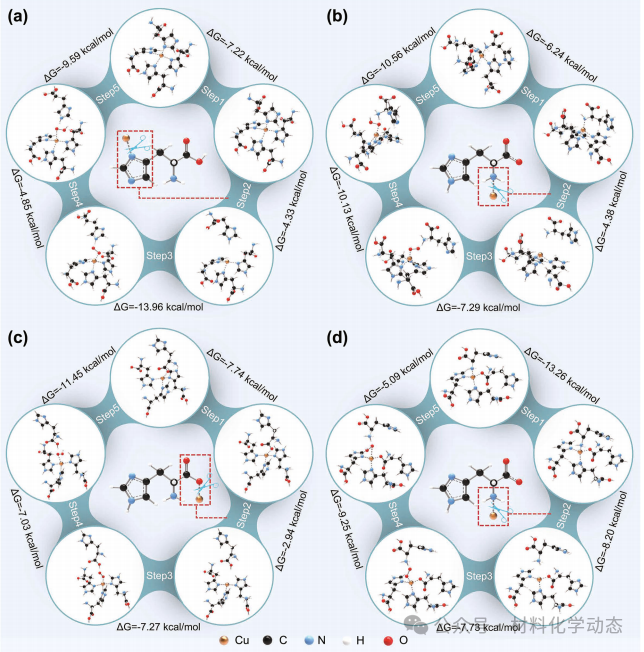
图3:不同结构Cu位点催化循环各步ΔG计算,结构D断裂Cu-氨基键ΔG仅-21.5 kcal mol-1,最易启动反应,活性潜力最大。
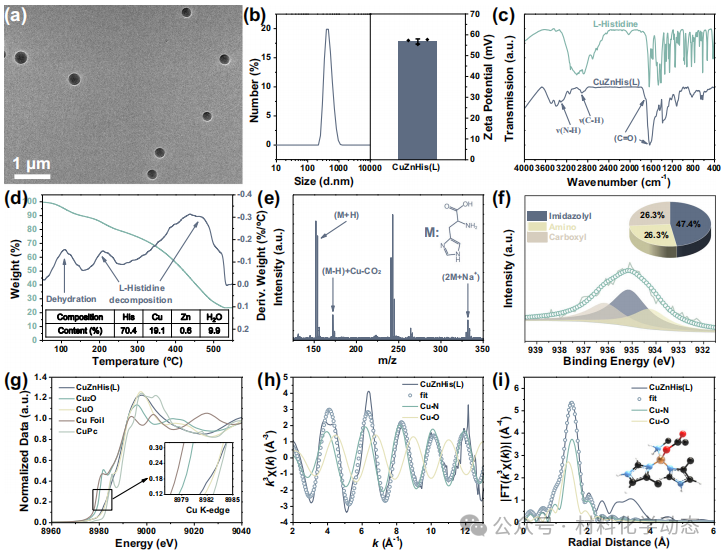
图4:CuZnHis(L)组装体表征—球状264 nm、无定形、Cu2+四配位(3N+1O)确认,组分质量比Cu:Zn:His:H₂O=19:1:70:10。
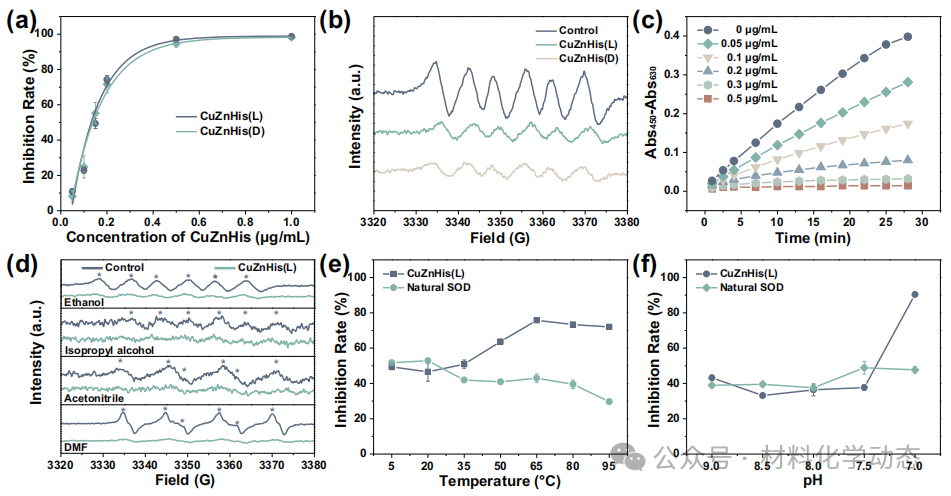
图5:SOD活性评估—CuZnHis(L)IC50=0.132 μg mL-1,比活37900 U mg-1,为天然酶5.4倍;耐溶剂、耐高温、耐酸碱,特异性高。
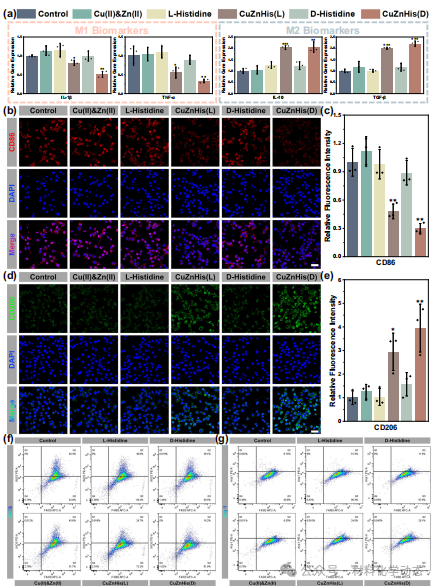
图6:体外抗炎机制—CuZnHis显著下调IL-1β/TNF-α/CD86/iNOS,上调IL-10/TGF-β/CD206/Arg-1,促M1→M2极化,D型效果更佳。
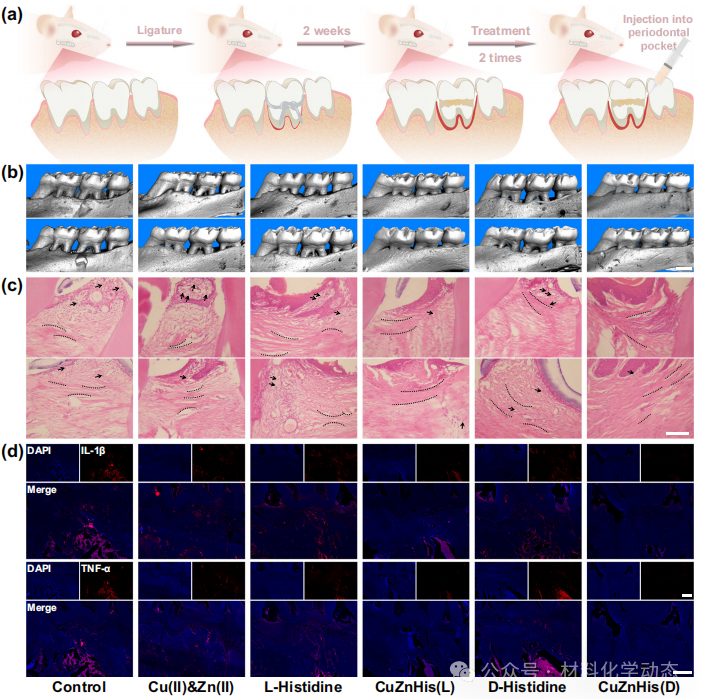
图7:雄性大鼠牙周炎治疗—Micro-CT、H&E、免疫荧光显示CuZnHis(D)组牙槽骨吸收减少52%,炎症细胞浸润下降,抗炎因子表达提升,疗效最佳且全身无毒。
综上,作者通过理论计算设计并自组装构建具有“一氨基-一羧基-二咪唑”优化Cu位点的Cu/Zn/组氨酸超分子纳米酶,实现高达37900 U/mg的SOD活性,为天然酶的5.4倍。该纳米酶在细胞与雄性牙周炎动物模型中均表现出优异的抗氧化、抗炎疗效及生物安全性,为氧化应激相关疾病提供高效、可扩展的人工酶替代方案。
Cu/Zn/histidine supramolecular assemblies with optimized Cu catalytic sites as an alternative of superoxide dismutase.Nat. Commun.,(2025).https://doi.org/10.1038/s41467-025-65074-7.