基于纳米疫苗的免疫疗法被认为是刺激宿主免疫系统识别和根除肿瘤,并建立长期免疫记忆以防止肿瘤复发和转移的主要手段。然而,抗原的弱特异性、低效的交叉呈递,以及肿瘤组织的免疫抑制微环境仍然是充分发挥肿瘤纳米疫苗治疗性能的主要障碍。

近日,吉林大学超分子结构与材料国家重点实验室刘轶、张皓等在《ACS Nano》上发表了题为“Ferroptosis and Necroptosis Produced Autologous Tumor Cell Lysates Co-Delivering with Combined Immnoadjuvants as Personalized In Situ Nanovaccines for Antitumor Immunity”的文章(DOI: 10.1021/acsnano.3c00901)。该工作设计并构建了铁-紫草素金属多酚网络包覆的负载了CpG ODN的羟基磷酸铝纳米颗粒(Alum-CpG@Fe-Shikonin NPs),作为个性化原位纳米疫苗用于抗肿瘤免疫治疗。在被肿瘤细胞内化后,Fe-Shikonin的金属多酚网络将拆解成Fe2+和Shikonin,通过诱导肿瘤细胞发生铁死亡和程序性坏死而引发免疫原性死亡。垂死的肿瘤细胞释放的自体肿瘤细胞裂解物会被Alum NPs吸附,并与CpG ODN一同被递送至树突细胞,从而激活多步级联抗肿瘤免疫反应,包括树突细胞成熟并通过MHC-I途径进行抗原交叉呈递;自然杀伤细胞和细胞毒性T淋巴细胞浸润到肿瘤组织中清除肿瘤细胞;肿瘤相关巨噬细胞从M2表型转变为M1表型,逆转肿瘤免疫抑制微环境等。最终,原位肿瘤疫苗建立了长期的免疫记忆以防止肿瘤转移和复发。得益于Alum NPs,CpG ODN和Fe-Shikonin MPN之间的协同作用,Alum-CpG@Fe-Shikonin NPs在抗肿瘤免疫方面表现出优异的治疗效果。
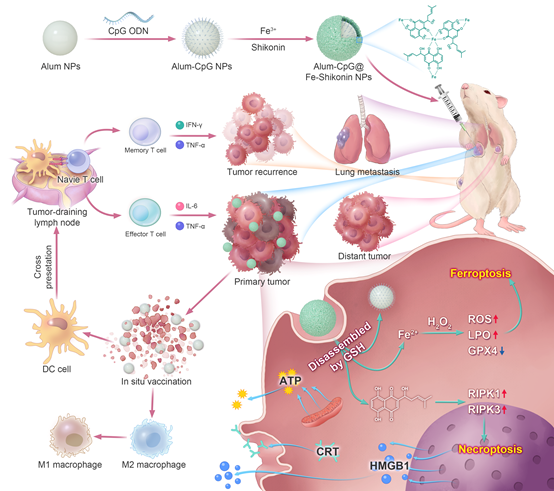
图1:个性化原位肿瘤疫苗的作用机制。
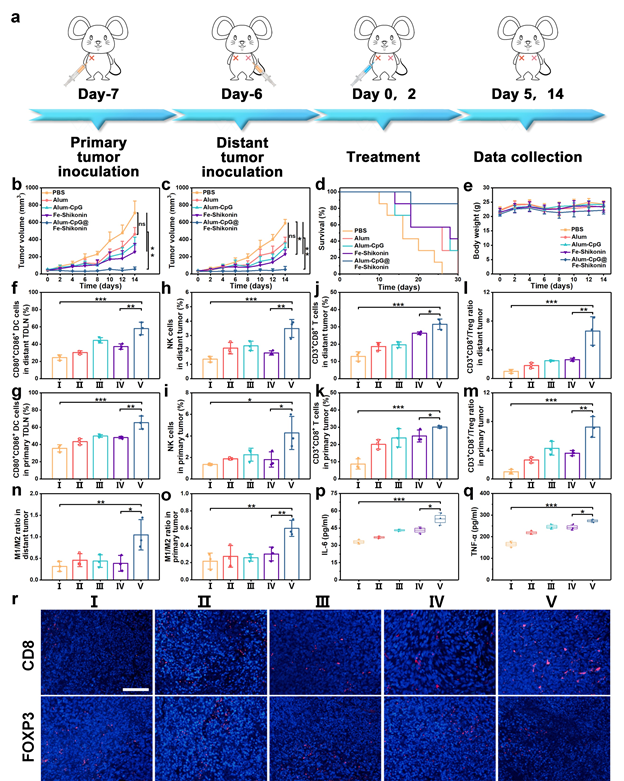
图2:个性化原位肿瘤疫苗的免疫治疗效果。
吉林大学刘轶教授、张皓教授为该文章的共同通讯作者,博士研究生石万瑞为该文章的第一作者。
原文链接:https://doi.org/10.1021/acsnano.3c00901